청신호 켜진 '연골 재생' 치료법…본격적 시장 열리나
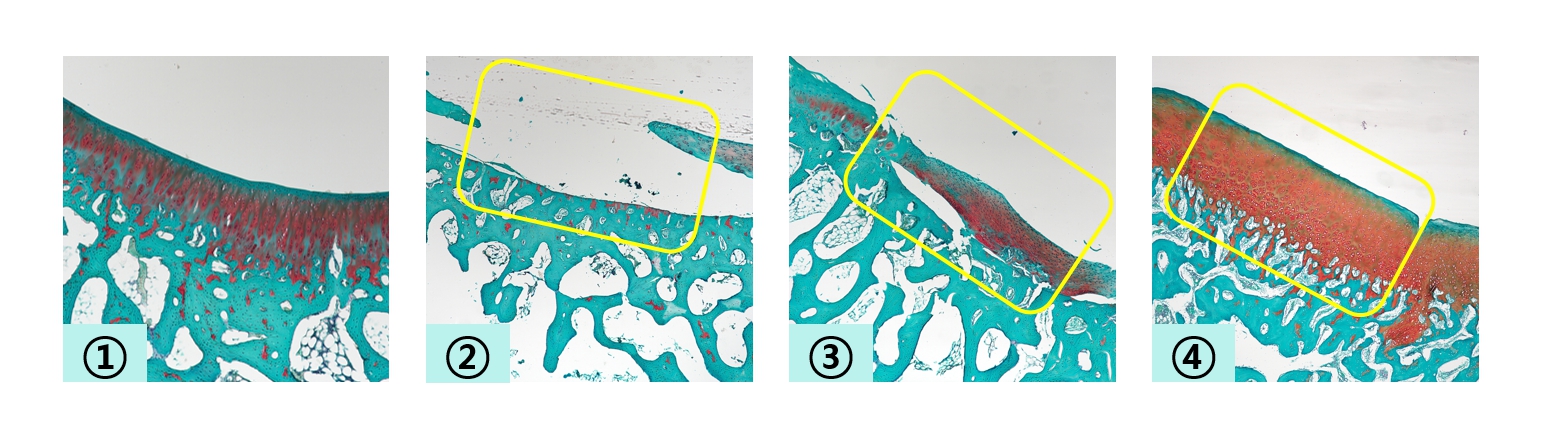
메디칼타임즈=문성호 기자보존적 치료에 머물렀던 연골 재생 치료에 변화를 일으킬 수 있을까.최근 국내 기업과 연구진이 연골 재생이 가능한 치료법 개발에 적극 나서고 있어 주목된다.왼쪽부터 정상 대퇴골, 연골 결손 대퇴골, 연골 결손 대퇴골에 TGF-β3 미포함 히알루론산 겔을 적용한 후 12주 시점, 연골 결손 대퇴골에 미세천공술을 적용하고 TGF-β3 포함 히알루론산 겔을 적용한 후 12주 시점이다.27일 시지바이오는 새롭게 개발한 ‘성장 인자 TGF-β3 함유 히알루론산(Hyaluronic Acid, HA) 겔’의 연골 재생 능력을 입증했다고 밝혔다. 이번 연구는 시지바이오와 전북대 강길선 교수 연구팀이 공동으로 진행한 것으로, TGF-β3를 함유한 히알루론산 겔을 이용해 토끼 슬관절 내 연골의 재생 능력을 평가했다. 해당 연구는 과학기술논문인용색인(SCI)급 국제학술지인 바이오머티리얼 사이언스(Biomaterials Science) 저널 2월 호에 게재됐다.연골은 뼈 사이의 마찰을 막아 관절부의 뼈를 보호하는 역할을 하는데, 연골이 손상되면 주위 관절 부위의 염증을 동반하고 만성적인 합병증을 유발할 수 있어 치료가 필요하다. 그러나 연골은 영양분을 공급하는 혈관이 통과하지 않는 조직인 데다, 인체의 무게를 지탱하며 하중을 지속적으로 받기 때문에 한번 손상되면 자연 치유가 불가하다.그러나 현재까지 개발된 치료법으로는 연골 자체의 재생 및 회복이 불가해, 통증 및 염증 완화를 위한 약물 치료 또는 연골 주위로 윤활성을 띈 물질을 주입해 더 이상의 연골 손상을 막는 치료를 시행해 왔다. 더불어 관절염이 진행되지 않은 경우라면 손상된 연골에 미세하게 상처를 내어 골수를 자극해 골수 내 자가 줄기세포가 병변으로 흘러나오게 해 연골을 재생시키는 ‘미세천공술’과 같은 방법을 사용하고 있지만, 이러한 치료 방법 역시 근본적으로 연골 자체를 재생 및 회복시키기에는 한계가 있었다.연구는 TGF-β3(Transforming Growth Factor beta 3)를 포함하는 높은 점착성을 가진 '히알루론산 겔'의 연골 치료 효과를 확인하고, 미세천공술을 통해 손상된 연골의 재생 촉진 여부를 평가하기 위한 목적으로 이뤄졌다.연구팀은 토끼 대퇴골 미세천공술 모델을 이용해, TGF-β3가 함유된 히알루론산 겔의 안전성 및 유효성을 확인하기 위한 최적 농도를 탐색하는 시험을 진행했다. 이어 대퇴골 결손 모델과 비교해, 대퇴골 미세천공술 병행 시 재생 촉진 효과를 평가했다. 연구 결과 TGF-β3가 함유되어 있지 않은 히알루론산 겔 대비, TGF-β3가 함유되어 있는 히알루론산 겔을 도포한 군에서 연골 재생 효과가 더욱 높게 나타났다. 이러한 결과는 대퇴골 결손모델과 대퇴골 미세천공술 모델 모두에서 동일한 추세를 나타냈다.이러한 결과는 시지바이오가 새롭게 개발한 히알루론산 겔이 기존의 겔 제제들보다 더 뛰어난 특성을 갖고 있기 때문이었다고 시지바이오 측은 전했다. 새로운 히알루론산 겔은 관절 내에서 높은 점착성을 보이며, 관절 활액에 희석되지 않고 결손 부위에 잘 부착돼 손상된 관절을 보호할 수 있는 물리적인 윤활 및 완충 작용을 제공한다.더불어, 히알루론산 겔은 담지된 TGF-β3를 효과적으로 방출해 관절 결손 부위에서 공급되는 중간엽 줄기세포(Mesenchymal Stem Cell, MSC)를 자극해, 연골 재생을 촉진하는 것으로 나타났다.유미영 시지바이오 연구2센터장은 "성장 인자 TGF-β3가 포함된 '히알루론산 겔'의 뛰어난 연골 재생 능력을 확인한 이번 연구결과를 바탕으로 빠른 시일 내 임상시험을 개시해 2026년 내로 연골 재생 의료기기의 출시 및 상용화를 추진할 계획"이라고 설명했다.